Duplicazione del genoma e progressione tumorale
Un team di ricercatori ha tracciato un percorso molecolare che può indurre le cellule a duplicare troppe volte il loro genoma. Le scoperte potrebbero essere utilizzate per sviluppare terapie in grado di interrompere questi eventi anomali nel ciclo cellulare,
La duplicazione del genoma promuove lo sviluppo del cancro
Il contenuto anomalo di DNA è una delle caratteristiche più comuni delle cellule tumorali, e recenti evidenze suggeriscono che il 35-40% dei tumori passa attraverso un evento di raddoppiamento dell'intero genoma (whole-genome doubling, WGD) durante la loro evoluzione. Il WGD è associato all'instabilità del genoma, alle metastasi e a una prognosi generale peggiore. I meccanismi molecolari che guidano il WGD sono poco conosciuti.
Il team di ricerca della Johns Hopkins Medicine ha osservato che le cellule “stressate” dopo aver copiato il genoma possono entrare in una fase di quiescenza, o senescenza, e correre il rischio di copiare nuovamente, per errore, il proprio genoma. Sebbene in genere queste cellule dormienti vengano spazzate via dal sistema immunitario dopo essere state riconosciute come difettose, a volte, soprattutto con l'invecchiamento, il sistema immunitario non riesce a eliminarle.
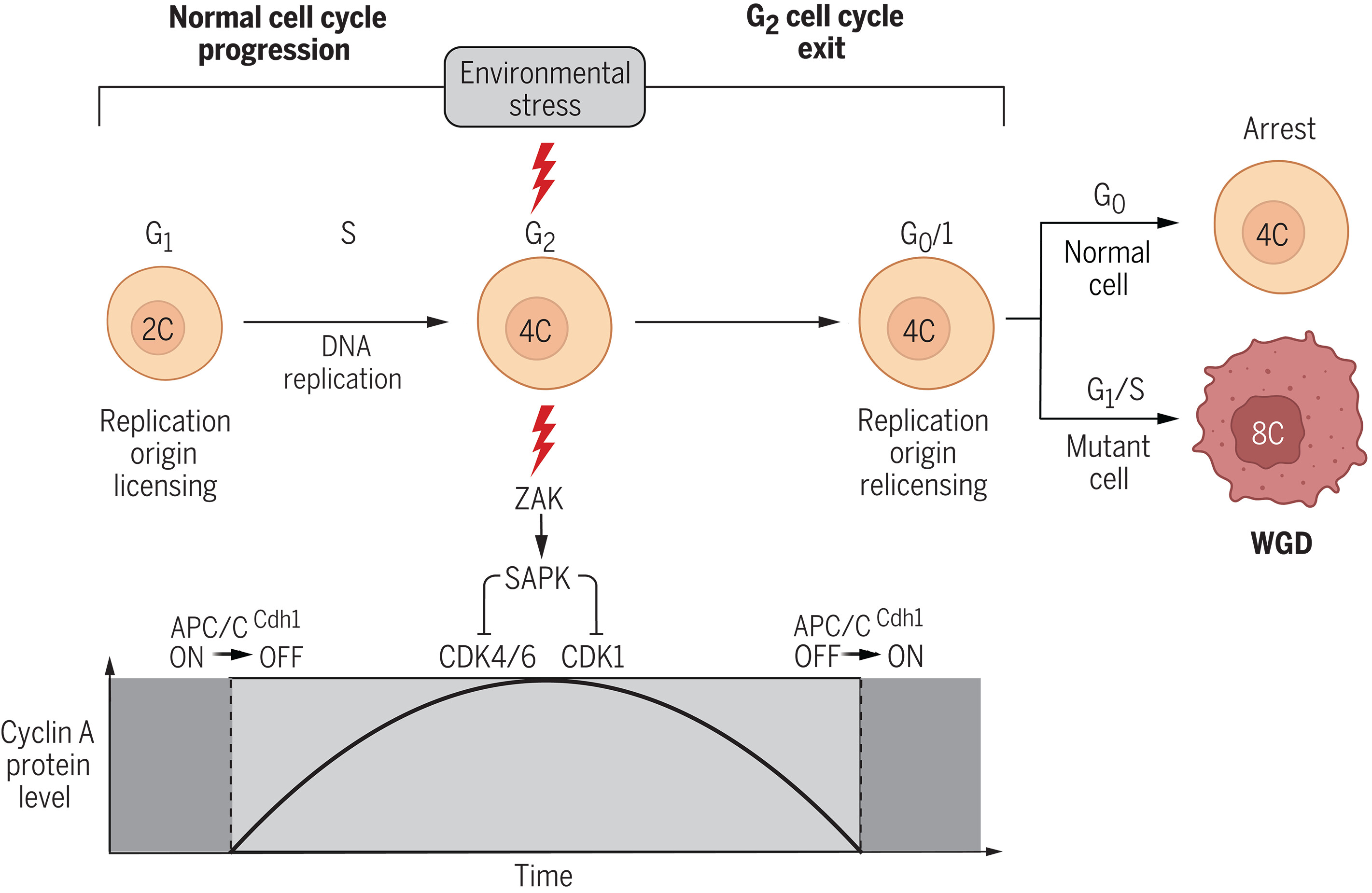
Lasciate sole, le cellule anomale possono replicare nuovamente il loro genoma, rimescolare i cromosomi alla divisione successiva e dare inizio a un cancro in crescita. Un modello noto come endoreplicazione, spiega il team nel suo articolo, è quello in cui la cellula subisce due cicli di replicazione del DNA senza divisione cellulare. L'endoreplicazione, hanno osservato, contraddice l'idea dell'impegno irreversibile alla divisione cellulare delle cellule che entrano nel ciclo cellulare. Secondo i ricercatori, sebbene la replicazione del DNA e la divisione cellulare siano accoppiate in circostanze normali, deve esistere un modo per disaccoppiare questi eventi durante i periodi di stress cellulare e rompere l'impegno alla divisione cellulare anche dopo che la replicazione del DNA è avvenuta.
Risposte allo stress e cellule tumorali
Nel tentativo di individuare i dettagli del percorso molecolare che va in tilt nel ciclo cellulare, Regot e colleghi della Johns Hopkins, si sono concentrati sulle cellule umane che rivestono i dotti mammari e il tessuto polmonare. Queste cellule si dividono generalmente a un ritmo più rapido rispetto ad altre cellule del corpo, aumentando le opportunità di visualizzare il ciclo cellulare.
Il laboratorio di Regot è specializzato nell'imaging di singole cellule, il che lo rende particolarmente adatto a individuare la piccolissima percentuale di cellule che non entrano nella fase dormiente e continuano a replicare il proprio genoma. Per lo studio appena pubblicato, il team ha esaminato migliaia di immagini di singole cellule durante la loro divisione cellulare. I ricercatori hanno sviluppato biosensori incandescenti per marcare le chinasi ciclina-dipendenti (CDK), enzimi cellulari noti per il loro ruolo nella regolazione del ciclo cellulare. Infatti gli eventi del ciclo cellulare sono coordinati dalle chinasi ciclina-dipendenti (CDK) per garantire una robusta divisione cellulare. Le CDK4/6 e CDK2 regolano la transizione dalla fase di crescita 1 (G1) a quella di sintesi (S) del ciclo cellulare.
Attraverso gli esperimenti, il team ha visto che una varietà di CDK si attivava in momenti diversi durante il ciclo cellulare. Dopo aver esposto le cellule a un fattore di stress ambientale, come un farmaco che interrompe la produzione di proteine, una radiazione UV o uno stress osmotico, i ricercatori hanno notato che l'attività di CDK 4 e CDK 6 diminuiva.
Poi, cinque-sei ore dopo, quando le cellule hanno iniziato le modificazioni preliminari alla divisione, anche la CDK 2 è stata inibita. A quel punto, un complesso proteico chiamato complesso promotore dell'anafase (anaphase promoting complex, APC) è stato attivato durante la fase appena precedente la mitosi. I ricercatori hanno evidenziato che, nell'ambiente stressato dello studio, l'attivazione dell'APC si è verificata prima della mitosi, mentre di solito si attiva solo durante la mitosi.
Circa il 90% delle cellule del seno e del polmone escono dal ciclo cellulare ed entrano in uno stato di quiete quando sono esposte a qualsiasi fattore di stress ambientale. Nelle cellule sperimentali degli scienziati non tutte le cellule si sono normalizzate. Il team di ricerca ha scoperto che il 5-10% delle cellule del seno e del polmone rientrava nel ciclo cellulare, dividendo nuovamente i cromosomi. Infatti, dopo aver alleviato lo stress, una frazione significativa di cellule ha subito un secondo ciclo di replicazione del DNA che ha portato al raddoppio dell'intero genoma..
Attraverso un'altra serie di esperimenti, il team ha collegato un aumento dell'attività delle protein-chinasi attivate dallo stress (stress activated protein kinases, SAPKs) alla percentuale di cellule che superano la fase di quiete e continuano a raddoppiare il proprio genoma. "Meccanicamente, l'uscita dal ciclo cellulare G2 avviene tramite l'attivazione prematura del complesso anafasico o ciclosoma (APC/C) in G2", hanno scritto. "In particolare, abbiamo scoperto che la riattivazione prematura dell'APC/C si verifica con l'inibizione persistente e simultanea della chinasi ciclina-dipendente 1 (CDK1) e della CDK4/6 in G2 da parte delle SAPK".
I meccanismi, hanno osservato, si verificano indipendentemente dalla proteina p53. Questa riattivazione prematura di APC/C ha portato all'endoreplicazione del genoma in un piccolo numero di cellule. La riattivazione di APC/C indotta dallo stress è stata guidata dall'inibizione di CDK4/6 durante l'arresto in G2, mettendo in discussione la definizione classica del punto di restrizione ed evidenziando un ruolo importante di CDK4/6 al di là della transizione da G0 a G1.
Un potenziale approccio terapeutico: bloccare l'attivazione precoce di APC
Secondo gli autori, potrebbero esistere farmaci in grado di bloccare l'attivazione di APC prima della mitosi per impedire alle cellule tumorali di replicare due volte il loro genoma e prevenire la progressione dello stadio tumorale. Gli autori hanno inoltre sottolineato che la segnalazione di SAPK svolge un ruolo centrale in una serie di condizioni di stress legate all'invecchiamento, tra cui lo stress proteotossico, lo stress ossidativo e l'infiammazione.
Nel contesto dei risultati del loro studio, hanno concluso: "Poiché l'endoreplicazione indotta da SAPK è indipendente da p53 e la maggior parte dei tumori con WGD perde la funzione di p53 prima della duplicazione del genoma, proponiamo che la WGD mediata da SAPK possa contribuire all'instabilità genetica e alla tumorigenesi nei tessuti che invecchiano".
Dato che l'inibizione di CDK4/6 è ora la terapia standard per il cancro al seno positivo per i recettori degli estrogeni, è importante studiare se questi inibitori possono promuovere eventi indesiderati di raddoppiamento dell'intero genoma e l'instabilità genomica nelle pazienti. Per rispondere a queste domande, saranno necessari approcci innovativi per tracciare in vivo i destini a lungo termine e la crescita clonale delle cellule tetraploidi derivanti dalle fasi G2 in cui l'attività di CDK4/6 è interrotta.
Fonte: McKenney C, Lendner Y, Guerrero Zuniga A, Sinha N, Veresko B, Aikin TJ, Regot S. CDK4/6 activity is required during G2 arrest to prevent stress-induced endoreplication. Science. 2024 May 3;384(6695):eadi2421. doi: 10.1126/science.adi2421. Epub 2024 May 3. PMID: 38696576.