Farmaci biosimilari in USA
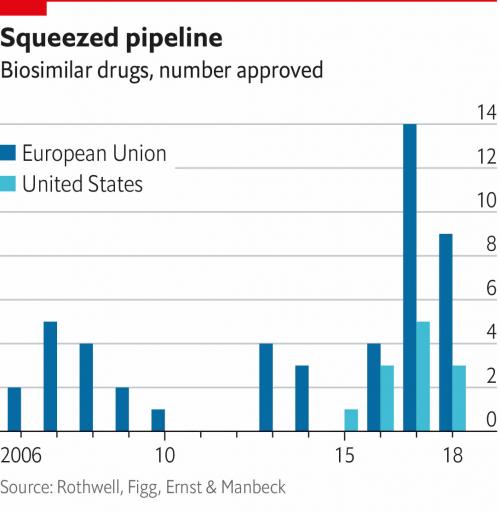
La Food and Drug Administration americana sta lavorando per ottenere la commercializzazione di farmaci biosimilari. Questi medicinali offrono una grande opportunità per i sistemi sanitari di risparmiare denaro. Mentre l’Unione Europea ha già approvato diversi farmaci biosimilari, gli Stati Uniti sono ancora in ritardo.
Gli Stati Uniti sono in ritardo con la commercializzazione dei biosimilari
La Food and Drug Administration americana sta lavorando per ottenere la commercializzazione di farmaci biosimilari. Questi medicinali offrono una grande opportunità per i sistemi sanitari di risparmiare denaro. Mentre l’Unione Europea ha già approvato diversi farmaci biosimilari, gli Stati Uniti sono ancora in ritardo. Questi ritardi sono costosi, sono in gioco milioni di dollari.
I farmaci biosimilari sono farmaci con caratteristiche simili a quelle di un farmaco biologico originario precedentemente brevettato e già utilizzato (il cosiddetto “farmaco di riferimento” o “farmaco originatore”). I farmaci biologici e i farmaci biosimilari sono ricavati da organismi viventi o microorganismi. Tra i farmaci biologici figurano ormoni, fattori di crescita, vaccini, e anticorpi monoclonali. Il biosimilare e il suo medicinale di riferimento sono di fatto uguali, ma potrebbero esserci differenze minime nei loro principi attivi. Queste differenze sono dovute al fatto che tali principi attivi sono in genere molecole grandi e complesse prodotte da cellule vive (non essendo prodotti di sintesi, come i farmaci generici, può esserci un certo grado di variabilità). Ogni eventuale differenza tra il biosimilare e il suo medicinale di riferimento è mantenuta entro limiti rigorosi per far sì che i due medicinali abbiano la medesima efficacia.
Il brevetto per la commercializzazione di un nuovo biologico dà all’azienda che lo ha scoperto un’esclusiva di 20 anni. Si presume infatti che, dopo 20 anni, siano stati ammortizzati i costi per la ricerca e lo sviluppo del nuovo farmaco. Dopo 20 anni di esclusiva sul farmaco biologico, altri produttori possono sviluppare e mettere sul mercato farmaci biosimilari, spesso a prezzi inferiori. La commercializzazione dei farmaci biosimilari a costi inferiori rispetto ai farmaci di riferimento facilita l'accesso dei pazienti alle terapie più moderne ed efficaci, impattando meno sull’economia dei sistemi sanitari. I medicinali biologici infatti sono spesso prescritti per la gestione di pazienti con malattie gravi e croniche, ad esempio patologie tumorali e infiammatorie.
I medicinali biosimilari sono utilizzati in piena sicurezza nell'Unione Europea dal 2006 come alternativa ai medicinali biologici di riferimento. Nell'UE l'autorizzazione dei medicinali biosimilari richiede una serie di dati diversa da quella necessaria per gli altri farmaci biologici, ma vengono applicati gli stessi standard elevati di qualità, sicurezza ed efficacia. Negli Stati Uniti, invece, la commercializzazione di farmaci biosimilari sta subendo diverse frenate da parte delle aziende farmaceutiche. È il caso, ad esempio, di Humira (Adalimumab), anticorpo monoclonale sviluppato da AbbVie ed utilizzato in patologie quali l’artrite reumatoide e l’artrite psoriasica. Un farmaco intorno al quale girano bilioni di dollari l’anno. L’Unione Europea potrà avvalersi del biosimilare, gli Stati Uniti dovranno aspettare, con tutte le conseguenze economiche che si possono immaginare.
Fonte: Can I borrow a molecule? Biosimilars. The Economist Espresso. Sep 4th 2018.