Questa non è medicina, è medicina di guerra
Abbiamo incontrato il Professor Luciano Gattinoni, uno dei massimi esperti di anestesia e rianimazione, Professore emerito delle Università di Milano e di Gottingen, Germania, dove ora vive, e gli abbiamo posto alcune domande sull’infezione da SARS-CoV-2.
Il Prof. Luciano Gattinoni descrive alcuni aspetti fisiopatologici e clinici dei pazienti COVID-19
Abbiamo incontrato il Professor Luciano Gattinoni, uno dei massimi esperti di anestesia e rianimazione, ex Direttore Scientifico del Policlinico di Milano, Professore emerito delle Università di Milano e di Gottingen, Germania, dove ora vive, e gli abbiamo posto alcune domande sull’infezione da SARS-CoV-2.
Buongiorno Professore, qual è secondo Lei la fisiopatologia del danno polmonare da COVID-19?
Credo che i maggiori problemi avvengano a livello vascolare. Diversi colleghi, infatti, mi stanno informando della presenza di moltissime cellule endoteliali nel sangue. Perché dico che è un problema vascolare, ad di là dei rilievi autoptici? Il motivo è molto semplice. Questi pazienti, nella fase iniziale della malattia, sono caratterizzati da una straordinaria dissociazione tra la quantità di gas all’interno dei polmoni, cioè l’elasticità polmonare e l’ipossiemia arteriosa. Normalmente, nelle insufficienze respiratorie acute che noi classifichiamo come ARDS, la bassa compliance polmonare si associa all’ipossia. È rarissima, una condizione che personalmente, in 40 anni di attività, non avevo quasi mai visto, una dissociazione di questo genere. Pazienti con compliance quasi normale che si presentano con una ipossiemia mostruosa, con valori di PaO2 di 35-40 mmHg ed una saturazione di 65-70%. Qual è quindi l’unica spiegazione di un fenomeno di questo genere? Lo scambio gassoso è matematica, non è supposizione. Sostanzialmente noi in questi malati abbiamo una enorme alterazione del rapporto ventilazione/perfusione. In questi pazienti si perde la regolazione del flusso polmonare, il flusso diventa maggiormente gravity dependent. Flusso sanguigno e ventilazione seguono quindi due strade diverse. il flusso va da una parte e la ventilazione va dall’altra. Abbiamo un aumento dello spazio morto, ad esempio.
Il polmone in questa fase non presenta ancora zone collassate e all’imaging vediamo alcuni aspetti ground glass soprattutto mantellari. Sono soprattutto mantellari perché è a livello mantellare che si concentra maggiormente lo stress e lo strain durante la ventilazione polmonare. Al di sotto della pleura, tra pleura e alveoli, ci sono differenze di elasticità, per cui abbiamo una concentrazione delle pressioni e dello stiramento polmonare proprio in quelle zone, che sono poi quelle che prima evidenziano il danno che si nota alla visione radiologica. Si tratta della visione ground glass, effetto di un edema molto localizzato e anche molto modesto.
All’ipossia come risponde il paziente? Quando si raggiungono i livelli di 40-50 mmHg, i nostri centri respiratori cominciano ad aumentare il volume corrente (tidal volume). Quindi si immagini di respirare al doppio del normale, di aumentare del 30-40% il proprio volume corrente. Questo avviene anche in assenza di dispnea, perché siccome la compliance è molto buona, quando il paziente aumenta il volume corrente è vero che fa un certo sforzo muscolare, ma è anche vero che a quello sforzo muscolare corrisponde il senso di riempimento che si aspetta, per cui non ha dispnea. Quando uno sportivo corre, infatti, non ha dispnea. La dispnea avviene quando si fa un certo sforzo muscolare per incamerare aria, il cervello attende una certa sensazione di riempimento, e invece l’aria non arriva.
Facendo questi sforzi, più il tempo passa, con l’aumentare di questi tidal volume, ovviamente il paziente deve aumentare anche le pressioni negative all’interno della pleura. L’aumento delle pressioni negative all’interno della pleura non fa altro che attirare più sangue centralmente. Aumenta la quantità di sangue centrale, aumenta la filtrazione in un polmone infiammato, aumenta l’edema. L’edema fa diventare il polmone come una spugna bagnata. Il polmone diventa più pesante e tende a collassare su se stesso. Allora l’imaging polmonare mostra un maggiore ground glass, si cominciano a vedere delle zone completamente bianche. Le zone bianche si notano alle basi. Questo è l’effetto dello schiacciamento del polmone. A questo punto l’evoluzione della malattia porta ad un aggravamento delle condizioni del paziente. Anche se il rianimatore riesce ad equilibrare la PaO2, aumentandola, questi pazienti sono caratterizzati da un drive respiratorio molto aumentato, che credo dipenda proprio dall’infezione virale, ma non sappiamo ancora con quale meccanismo preciso.
Il progresso della malattia è quindi dovuto, oltre alla severità dell’infezione, anche a questi fattori meccanici. Quando il paziente arriva ad avere grande dispnea, con un quadro TC che mostra grave compromissione polmonare, allora, solo allora, il paziente rientra nella cosiddetta ARDS. Il problema a mio parere sta nel trattare dall’inizio un paziente che si presenta con grave ipossiemia come se avesse una ARDS. Qui si commette un errore notevole, con delle conseguenze anche importanti.
In un paziente affetto da ARDS bisogna mantenere stabili i parametri in terapia intensiva ed aspettare che la tempesta passi. Io credo che la mortalità in terapia intensiva di questi pazienti non dovrebbe essere superiore al 15-20%. Attualmente è molto di più alta, temo ci aggiriamo intorno al 40%, perché non si riescono a curare i pazienti come si dovrebbe. Sono pazienti che vengono ricoverati in terapia intensiva in ritardo, magari dopo 4 giorni di ventilazione non invasiva, di casco CPAP, di tutti i vari rimedi di cui si racconta in giro. Sono pazienti su cui si tentano farmaci senza precise evidenze scientifiche. La medicina non si basa sull’aneddotica (soprattutto su quella che gira in Internet), ma su prove fondate. Io so per certo una cosa, che fino a quando non si conoscono i meccanismi, la terapia non può essere adeguata. Senza evidenze scientifiche, la somministrazione di qualunque farmaco non ha molto senso.
In un’ottica di risorse limitate la loro corretta attribuzione riveste un ruolo fondamentale. Per cui è necessario non ospedalizzare il paziente che non lo necessita, ma anche e soprattutto ospedalizzare quello che necessita, con il corretto timing. Quale secondo Lei è il corretto criterio di ospedalizzazione dal territorio? Ad esempio: saturimetria tout court, saturimetria walking test, ecografia - in un’ottica di poterla fare?
Bisognerebbe fare una misurazione che non credo rilevi nessuno, ovvero misurare lo sforzo inspiratorio, la negatività della pressione pleurica che il paziente presenta in quel momento. Se il paziente ha una pressione pleurica molto negativa, che supera i 12-15 cmH2O, sappiamo per certo, abbiamo evidenze sperimentali ampissime in merito, che un polmone sano viene distrutto in 24-48 ore. Se arriva all’osservazione un paziente che ha dispnea, quello che farei subito è misurare la pressione con un pallone esofageo, oppure mi soffermerei sull’aspetto della meccanica respiratoria: sulla contrazione dello sternocleidomastoideo, sui movimenti diaframmatici e intercostali, sugli spostamenti dell’addome, o valuterei variazioni della pressione venosa centrale, che vanno di pari passo con le variazioni della pressione pleurica, userei l’ecografo per analizzare gli spostamenti del diaframma. Abbiamo diversi sistemi che quantificano lo sforzo respiratorio.
Un paziente che non presenta sforzo respiratorio ci tranquillizza. Potrà peggiorare, certo, ma ce ne accorgeremo se aumenterà lo sforzo respiratorio. A questo punto, quando valuto la presenza di uno sforzo respiratorio eccessivo, posso provare ad usare un casco CPAP. Immaginiamo di mettere la CPAP a 15 cmH2O. Per alcuni pazienti è la terapia giusta, perché lo sforzo respiratorio diminuisce, quindi si interrompe il circolo vizioso che porta all’aggravamento. Ma per altri pazienti no, perché lo sforzo respiratorio potrebbe non diminuire e rimanere molto alto. Inoltre, con una pressione di 15 cmH2O, si rischia di mandare in crisi il ventricolo destro. La pressione positiva infatti comporta problemi di emodinamica. I pazienti possono diventare ipotesi, gli si somministra noradrenalina, col rischio che dopo 24 ore mostrano insufficienza renale. A quel punto, chiaramente, serve l’intubazione, un ventilatore, un medico e due infermieri che se ne occupino.
Diversi ospedali si sono trovati a dover fronteggiare una sproporzionata domanda di cure intensive a fronte di una ridotta offerta. Di necessità, diversi pazienti sono stati assistiti con metodiche non invasive (CPAP, NIV), più maneggevoli e meno costose in termini di mezzi e risorse. Cosa pensa al riguardo?
Faccio fatica a rispondere a questa domanda. In questa situazione va bene quello che si fa, mi viene da dire. Casco CPAP, 10-15 cmH2O di PEEP e vediamo come va… Ma questa non è medicina, questa è medicina di guerra. Nella quale si possono usare anche score per decidere quali pazienti meritano di essere visitati e quali no. La medicina è un’altra cosa.
In diversi ospedali si è reso necessario l’aumento dei posti di terapia intensiva, senza un corrispondente aumento di medici intensivisti e di infermieri di area critica. In una recente intervista in TV Lei ha ristabilito la dignità della professione definendola “paranoica attenzione ai dettagli da parte di persone che lo sappiano fare”. Posizionare più tubi, a fronte dell’ovvia mancanza di attenzione ai dettagli che ne deriva, da solo non è un parametro in grado di aumentare la sopravvivenza. Nell’ottica di lavorare “al meglio possibile” e non agendo di cesello come solitamente si fa in terapia intensiva, quali “dettagli” ritiene prioritari da osservare nei pazienti COVID?
I miei colleghi stanno facendo sforzi enormi per gestire questa situazione. In Italia, ma non solo.
Ho colleghi che in 40 anni di esperienza non si sono mai trovati davanti scenari come quelli che stiamo vivendo oggi. Non abbiamo farmaci, mancano i letti, manca la possibilità e il tempo per osservare. La terapia intensiva ha bisogno di 1 infermiere ogni 2 letti. Se dove si curavano 10 pazienti oggi se ne curano 40, con lo stesso numero di medici e di infermieri, quella non è più terapia intensiva. 1 medico ogni 10 malati non è terapia intensiva. La terapia intensiva non si fa con un letto e un respiratore. Serve anche chi si possa dedicare ai pazienti dedicando il giusto tempo, chi lo sappia fare. Non sono cose che si improvvisano in due settimane.
Le terapie intensive hanno medici ed infermieri capaci, abituati a situazioni critiche, a pazienti che non rispondono alle cure, a turni massacranti. Credo che le terapie intensive stiano riuscendo bene a sostenere il peso di questa emergenza.
Il vero problema, secondo me, è fuori dalle terapie intensive, nelle cosiddette sub-intensive dove, per necessità, stanno lavorando medici che di solito fanno altro. Abbiamo medici che stanno conoscendo ora cos’è una CPAP, che la stanno usando senza conoscerne i meccanismi. Si immagini cosa potrebbe succedere se a me domani dicessero di andare in sala operatoria per operare una frattura di femore. Non stiamo parlando di medicina, lo ripeto.
Capisco che in queste prime fasi di emergenza si siano dovuti trovare sistemi diversi dall’ordinario. Ma adesso, si spera il prima possibile, avremo un lungo periodo in cui il numero di pazienti diminuirà e si potrà tornare a curarli. La mortalità diminuirà, ma dovremo avere dati, accumulare esperienze ed errori su come trattare questi pazienti.
Io credo, lo ripeto, che oggi l’errore fondamentale sia trattare questi pazienti come se avessero tutti una ARDS severa. Come varcano la soglia dell’ospedale, gli si mette un casco CPAP, 15 cmH2O di PEEP e si sta a vedere quello che succede, limitandosi a valutare la sola ossigenazione. L’ossigenazione è l’ultimo segno di un processo che sta a monte che bisogna conoscere. Se non si conoscono questi pazienti, non si curano in modo corretto. Adesso mancano dati, ma presto, spero, ne avremo.
In alcuni ospedali si sta diffondendo la tecnica della posizione prona dei pazienti in respiro spontaneo e/o assistiti con CPAP e la saturazione spesso sale in maniera considerevole. Cosa ne pensa? Può essere veramente vantaggiosa o mascherare la gravità del quadro e ritardare pericolosamente il momento in cui si arriva all’intubazione?
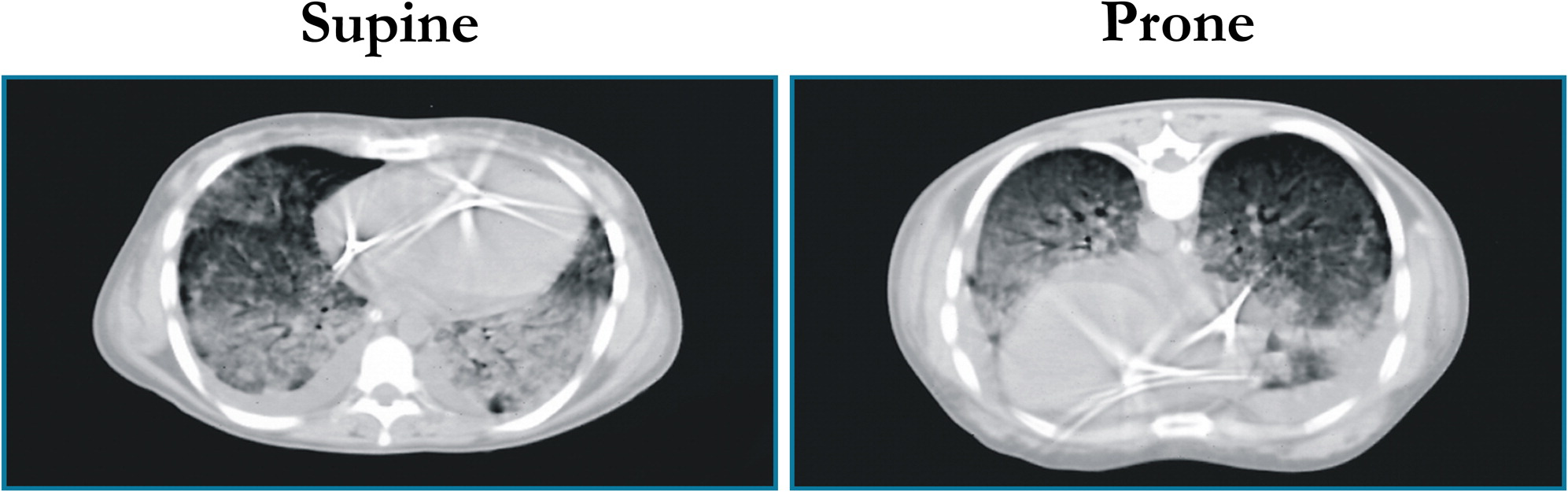
Al Policlinico di Milano siamo stati tra i primi ad introdurre la posizione prona. In letteratura, lo abbiamo scoperto poi, esisteva solo un articolo aneddotico del 1972 in cui una dottoressa riferiva di aver messo pazienti a pancia in giù e di aver notato un miglioramento dell’ossigenazione.
Osservando le TC polmonari dei pazienti con insufficienza respiratoria acuta in posizione supina, noi vedevamo che tutte le lesioni erano sostanzialmente dipendenti, cioè nelle zone del polmone più vicine alle vertebre, mentre in alto, verso lo sterno, il polmone non sembrava tanto compromesso. La sola radiografia, invece, ci diceva che era coinvolto tutto il polmone. Allora la cosa più naturale ci sembrò quella di mettere i pazienti a pancia in giù. Notammo che l’ossigenazione saliva. Perché saliva l’ossigenazione?
Noi pensavamo che l’aumento dell’ossigenazione fosse motivato dallo spostamento di flusso in quella parte di polmone con minori densità osservabili alla TC, quello che noi abbiamo chiamato baby lung. Sottoponendo i pazienti in posizione prona a TC fummo sorpresi nel vedere un aumento di densità verso lo sterno. Nacque così il modello, ancora valido, del polmone assimilabile ad una spugna.
Si immagini una spugna asciutta, che ha pori di una certa dimensione. Immaginiamo quindi di mettere questa spugna nell’acqua. Togliamola dall’acqua e osserviamola appoggiata sul bordo della vasca da bagno. Si vedrà che i pori in basso diminuiscono di volume perchè sono schiacciati dal peso della spugna sovrastante. Mettendo il paziente in posizione prona, è come se il polmone/spugna obbligasse l’aria ad uscire dalle parti posteriori. Liberando le parti posteriori del polmone prima schiacciate e comprimendo un po’ quelle anteriori, siccome la perfusione rimane invece uniforme, a differenza di quanto pensavamo in precedenza, allora in questo modo si ha una porzione maggiore di polmone “aperto”, cosa che fa aumentare l’ossigenazione. Questo è il meccanismo principale, poi esistono altri 2-3 meccanismi minori.
Una tomografia computerizzata rappresentativa di un paziente con ARDS
in posizione supina (a sinistra) e in posizione prona (a destra)
I pazienti affetti da COVID-19 in fase iniziale non presentano edema, ossia un polmone che somiglia ad una grossa spugna piena d’acqua. In fase iniziale si ha un rapporto ventilazione/perfusione alterato. Allora, mettendo questi pazienti in posizione prona, otteniamo benefici grazie al primo meccanismo che ho descritto. Siccome abbiamo una perfusione che tende ad andare gravitariamente, quando mettiamo i pazienti a pancia in giù, noi mettiamo in condizioni più favorevoli di perfusione la parte non dipendente del polmone, ossia la massa maggiore del polmone che sta verso l’alto. Quindi, con un meccanismo diverso, il risultato finale è lo stesso. Ovviamente se la situazione si aggrava e comincia ad aumentare l’edema, quando il polmone diventa un bello spugnone per intenderci, la posizione prona ci dà benefici attraverso il secondo meccanismo.
Quello che si sta vedendo adesso, anche con la TC, è il corrispettivo di questo. Ci sono due fasi della malattia. In una prima fase pazienti hanno polmoni “L-light” (alta compliance, basso V/Q): in questi pazienti il polmone non pesa tanto quindi non ho l’effetto spugna. In una seconda fase i polmoni diventano “H-heavy” (più simili al quadro di ARDS) e avranno una ridistribuzione delle densità come nell’ARDS classica. I primissimi dati che abbiamo vanno in questa direzione.
Quando estubare un paziente COVID-19 secondo Lei? Quale il setting più corretto a fronte della limitatezza delle risorse? Il mantenimento in terapia intensiva o il passaggio in pneumologia/riabilitazione?
L’estubazione sarà possibile solo quando, ad una diminuzione del supporto, questi pazienti non scatteranno con un drive respiratorio terrificante. Se invece riescono a respirare in modo proporzionale possono essere ovviamente svezzati.
La media di degenza in terapia intensiva è di circa una decina di giorni sia per i pazienti che hanno un buon andamento e mostrano segni di ripresa, sia per i pazienti che peggiorano fino al decesso. Poi abbiamo un terzo gruppo di pazienti, circa il 60%, che hanno un andamento incerto, per i quali non possiamo prevedere un esito. Qui occorre molto più tempo. In questa patologia la cosa che occorre avere è pazienza. A un miglioramento dello scambio gassoso, che può avvenire anche in fretta, non deve corrispondere uno smanettamento del ventilatore. Le condizioni del paziente infatti non sono certamente cambiate. Bisogna aspettare che la malattia faccia il suo corso e avere pazienza. Una delle cose più difficili in terapia intensiva è non fare niente, ma è quello che occorre fare in questi pazienti.
Pazienti che io terrei tutti in terapia intensiva, perché nella realtà italiana sono i rianimatori ad avere le maggiori competenze in ambito di gestione dei pazienti con grave infezione polmonare.
Fonte immagine: Gattinoni L, Taccone P, Carlesso E, Marini JJ. Prone position in acute respiratory distress syndrome. Rationale, indications, and limits. Am J Respir Crit Care Med. 2013 Dec 1;188(11):1286-93. doi: 10.1164/rccm.201308-1532CI.